Desarrollo y caracterización de cultivos neuronales primarios para estudios biomédicos en Panamá


Autores/as
DOI:
https://doi.org/10.37980/im.journal.rmdp.20252470Palabras clave:
animales de laboratorio, cultivo neuronal primario, inmunocitoquímicaResumen
Introducción: Los cultivos neuronales primarios son una de las técnicas más utilizadas en investigación preclínica para entender el comportamiento celular y molecular de las células del tejido cerebral, y consisten en el mantenimiento in vitro de células procedentes del cerebro de animales de laboratorio. Estos cultivos pueden variar dependiendo de la población celular que se aísle del tejido y su tratamiento, permitiendo evaluar la interacción de diferentes tipos celulares entre sí o evaluando el comportamiento de un tipo celular específico. Objetivo: El objetivo de este proyecto es desarrollar dos protocolos para cultivos neuronales primarios: un cultivo neuronal enriquecido de neuronas y un cultivo mixto. Metodología: Se utilizaron embriones de 17 días de gestación de ratas Sprague Dawley y se aislaron células de la corteza que se mantuvieron in vitro durante 10 días con diferentes tratamientos para favorecer, o no, un tipo de célula. La caracterización de los cultivos se realizó mediante inmunofluorescencia indirecta con microscopia confocal para obtener las imágenes, y el procesamiento de éstas se realizó utilizando el software ImageJ. Resultados: Se establecieron protocolos para cultivos neuronales primarios enriquecidos de neuronas y para cultivos mixtos. Los cultivos diferían en la cantidad de células totales, proporción de neuronas (90% y 30% respectivamente) y en la cantidad de astrocitos. Estos cultivos podrán ser utilizados para entender el comportamiento de las células cerebrales y la respuesta de estas a diferentes estímulos. Conclusión: Hemos establecido dos protocolos para producir cultivos neuronales primarios: un protocolo para cultivos enriquecidos de neuronas y otro para cultivos mixtos. El cultivo enriquecido podrá ser utilizados para entender el comportamiento específico de las neuronas y su respuesta a diferentes intervenciones, mientras que el cultivo mixto permitirá entender la interacción de las neuronas con las demás células cerebrales y las respuestas que esa interacción produzca.
Introduction: Primary neuronal cultures are one of the most widely used techniques in preclinical research to understand the cellular and molecular behavior of brain tissue cells, and consist of the in vitro maintenance of cells from the brain of laboratory animals. These cultures can vary depending on the cell population to be isolated from the tissue and its treatment, allowing to evaluate the interaction of different cell types with each other or evaluating the behavior of a specific cell type. Objective: The objective of this project is to develop two protocols for primary neuronal cultures: a neuronal culture enriched with neurons and a mixed culture. Methodology: 17-day gestation embryos from Sprague Dawley rats were used and cells were isolated from the cortex and maintained in vitro for 10 days with different treatments to favor, or not, one cell type. Characterization of the cultures was performed by indirect immunofluorescence with confocal microscopy to obtain the images, and image processing was performed using ImageJ software. Results: Protocols were established for primary neuronal cultures enriched in neurons and for mixed cultures. The cultures differed in the number of total cells, proportion of neurons (90% and 30% respectively) and in the number of astrocytes. These cultures can be used to understand the behavior of brain cells and their response to different stimuli. Conclusion: We have established two protocols to produce primary neuronal cultures: one protocol for enriched neuronal cultures and another for mixed cultures. The enriched culture can be used to understand the specific behavior of neurons and their response to different interventions, while the mixed culture can be used to understand the interaction of neurons with other brain cells and the responses that this interaction produces.
Las enfermedades neurológicas son un gran problema de salud pública. En el año 2015 los trastornos neurológicos representaban el 6,3% de la carga de enfermedad global, siendo la enfermedad cerebrovascular y las infecciones neurológicas responsables del 4.3% [1]. La prevalencia de las enfermedades neurológicas ha incrementado de manera continua y para el 2021 se determinó que 43.1% de la población mundial estaba afectada por una enfermedad neurológica [2]. En Panamá no contamos con un registro adecuado de la morbilidad por enfermedades neurológicas, pero sabemos que desde el 2002 hasta el 2021, estas enfermedades han representado alrededor del 10 % de la mortalidad en el país [3], [4], [5].
Existen pocos tratamientos eficaces para el manejo de los pacientes que sufren estas enfermedades y en parte esto se debe al poco conocimiento que tenemos sobre los mecanismos moleculares asociados a estas patologías [6], [7], [8]. Para entender la fisiopatología de los trastornos neurológicos es necesario el uso de modelos preclínicos como los cultivos neuronales [9].
Dentro de las investigaciones preclínicas, los cultivos celulares, y en especial los cultivos neuronales primarios, son uno de los modelos más utilizados [10], [11]. Los cultivos neuronales primarios consisten en el mantenimiento in vitro de células procedentes del tejido cerebral de animales de laboratorio, principalmente de roedores [10]. Estos cultivos pueden variar dependiendo de la población celular que se logre aislar del tejido cerebral y su tratamiento, lo que finalmente define su conformación. Se consideran cultivos mixtos si la población celular es heterogénea, conteniendo neuronas y células de glía; mientras que los cultivos neuronales enriquecidos o puros son cultivos con una predominancia de neuronas [12]. Los cultivos mixtos permiten evaluar el comportamiento entre los distintos tipos de células del sistema nervioso; mientras que los cultivos enriquecidos o puros permiten evaluar el comportamiento de las neuronas, específicamente.
Las neuronas son consideradas el componente principal del tejido cerebral, por lo que conocer su comportamiento de manera individual y en interacción con los otros tipos celulares del cerebro se ha vuelto una prioridad en neurociencias. Por esta razón, el objetivo de este estudio es establecer el desarrollo y caracterización de cultivos neuronales primarios enriquecidos de neuronas y mixtos, utilizando embriones de 17 días de gestación de ratas Sprague Dawley.
- Manejo de animales de laboratorio
El proyecto fue aprobado por el Comité Institucional para el Cuidado y Uso de los Animales de Laboratorio de INDICASAT AIP (CICUA 21-006) y todos los métodos de manejo de los animales se realizaron siguiendo las regulaciones y guías relevantes, como se ha descrito anteriormente [13]. De manera resumida, se utilizaron ratas Sprague Dawley con ciclos de luz/oscuridad de 12 horas, agua y comida a libre demanda. Para producir ratas gestantes programadas, se evaluó el ciclo estral mediante citología vaginal. La hembra en estadio de estro era colocada en el hábitat del macho durante el ciclo de oscuridad para el apareamiento. Al día siguiente, se evaluó la presencia de signos de copulación, la presencia de tapón mucoso y espermatozoides, o la detención del ciclo estral. La hembra gestada recibo seguimiento durante 17 días mediante inspección clínica y evaluación del peso. En el día 17, la rata fue anestesiada con isoflurano y se le realizo eutanasia para obtener los embriones (E17) mediante incisión abdominal.
- Cultivo neuronal primario
Los embriones fueron decapitados y el cerebro se colocó en una solución de HBSS (Sigma-Aldrich), HEPES (10mM) (15630-080, gibco), piruvato de sodio (1X) (11360-070, gibco) y glucosa (0.1%) (E701-100ml, VWR). La disección de la corteza de los hemisferios se realizó con el estereoscopio SMZ660 (Nikon, Tokio, Japón) y pinzas Dumont de punta fina (Ted Pella, Redding, CA, EEUU). El tejido se colocó en solución de tripsina 0.25% (Thermo Fisher) y 0.5 ml DNasa (DN25, Sigma Aldrich, Burlington, MA, EEUU). Luego se sometió a disociación con micropipeta de 1000 µl (Superpette, Scilogex) (10 repeticiones) y se filtró utilizando filtro de 40um (352340, Corning). Por último, las células fueron centrifugadas a 1000 rpm X 5 min (Universal 320/Hettich) y resuspendidas en medio compuesto por DMEM (D6429, Sigma-Aldrich), suero fetal bovino (10%) (F2442, Sigma-Aldrich), penicilina/estreptomicina (5%) (15-140-122, Thermo Fisher) y glutamina (5%) (11574466, Thermo Fisher). Se sembraron 5x105 células por pocillo en platos de 24 pocillos (351147, Falcon) que contenían cubreobjetos tratados con poly-D-lisina (GG-12-Laminin, Neuvitro, Vancouver, WA, EEUU). Los cultivos se mantenían in vitro durante 10 días con los siguientes tratamientos:
- Cultivos enriquecidos de neuronas: El primer cambio de medio se realizó a las 2 horas de la siembra por medio de mantenimiento compuesto por Brainphys neuronal media (Stemcell), 2% de suplemento SM1 (Stemcell Technologies, Vancouver, BC, Canada) y 0.5mM Glutamax (Thermofisher Scientific, Waltham, MA, EEUU). A las 48 horas de la siembra, se aplicaba 1.5uM citarabina (100071, MP Biomedicals) por 48 horas. Pguraa or último, se realizaba cambio de medio parcial (50%) cada 72 horas.
- Cultivos mixtos: El primer cambio de medio se realizó a las 24 horas de la siembra con medio de mantenimiento y luego cada 72 horas se realizaba cambio de medio parcial ( VER FIGURA 1).
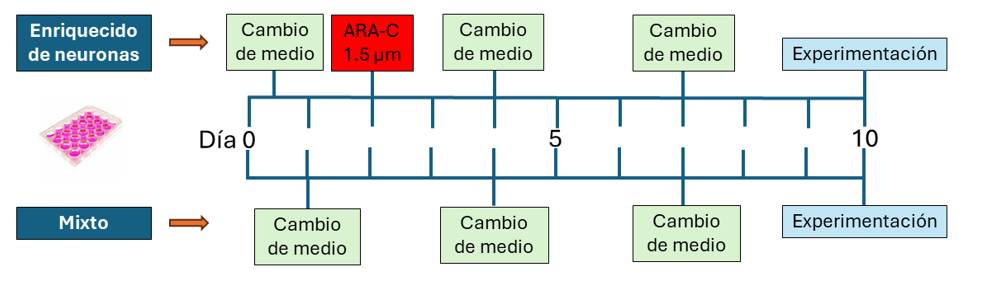
- Inmunocitoquímica
Al décimo día in vitro (DIV), los cultivos fueron fijados con paraformaldehido al 4% durante 15 min a temperatura ambiente, seguido de lavado con PBS y agitación a 80 rpm por 5 min. Después de 24 horas se aplicó solución de bloqueo (2% albumina de suero bovino (A9647, Sigma-Aldrich), 0.3% Triton X-100 (T8787, Sigma-Aldrich), 0.02% de azida (S0209, TEKNOVA)) y se agitó durante 1 hora a 80 rpm. Luego se aplicaron los anticuerpos primarios [Anti-FOX3 (834501, Biolegend, San Diego, CA, EEUU), Anti-GFAP (ab4648, Abcam, Cambridge, UK) y Anti-B3 tubulina (ab18207, Abcam)] y se incubaron durante la noche. Al día siguiente se realizaron lavados con PBS 1X (76470-186) y los cubreobjetos se incubaron durante 1 hora con el anticuerpo secundario [Anti-Rabbit DyLight-488 (ab96923, Abcam) y anti-mouse CF-633 (Sigma Aldrich)]. Se realizaron lavados con PBS y por último los cubreobjetos se colocaron en portaobjetos con Fluoroshield (F6057-20ML, Sigma Aldrich).
- Microscopia de fluorescencia
Las imágenes se obtuvieron con un microscopio Confocal FV3000 (Olympus, Tokio, Japón). Se seleccionaron 5 regiones en cada cultivo para fotografiar (superior, inferior, izquierda, derecha y centro). Las imágenes se obtuvieron con una magnificación de 400x y los cortes en profundidad (stacks) mantenían una separación de 0.08 µm.
- Análisis de imágenes
Se utilizó el software ImageJ (1.54i) para el análisis y la obtención de datos de las imágenes. Para el conteo celular se realizó una proyección en Z de los stacks, con preprocesamiento de brillo y contraste con ajuste automático. La segmentación se realizó con la función auto treshold. Por último, se utilizó la función analyze particle para identificar, medir y contar los objetos detectados.
- Análisis estadístico
Para cada experimento se utilizó una N=3, cada una con 3 réplicas. Para el análisis de los astrocitos se evaluaron 50 astrocitos por tipo de cultivo. El análisis descriptivo consistió en cálculo de frecuencias, porcentajes y medidas de tendencia central. El análisis comparativo se realizó con la prueba t de student, se consideró como significativo un valor de p<0.05.
Cultivos Enriquecidos de neuronas
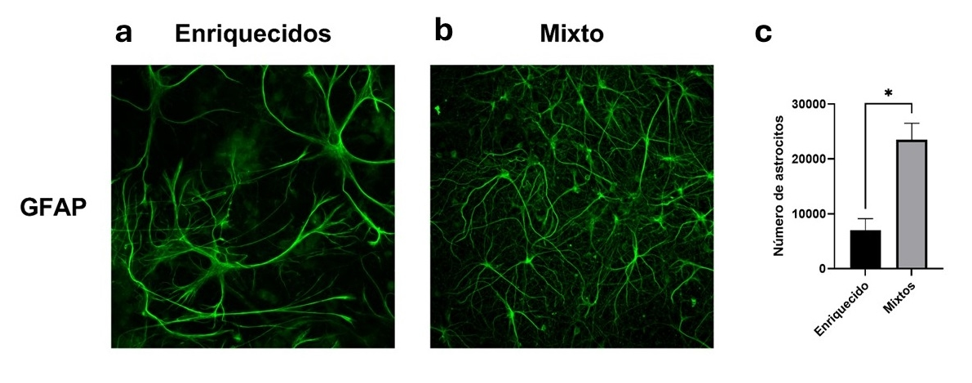
En cada pocillo se colocaron 500,000 células el día de siembra, y veinticuatro horas después los cultivos enriquecidos de neurona presentaban un total de 342,849 + 105,488 células, lo que representa la supervivencia del 68.5 %. Las neuronas contabilizaron un total de 174,701 + 57,510, correspondiendo al 51.09 + 1.96 %. Al décimo DIV, los cultivos enriquecidos de neuronas presentaban un total de 253,984 + 14,087 células, lo que representa una disminución del 25.92 % con respecto al DIV 1. De este total al DIV 10, 225,165 + 14,316 eran neuronas, lo que representó el 88.4 + 2.3 % de las células. Los cultivos enriquecidos de neuronas no mostraron una diferencia significativa en la cantidad de células (t(4)= 1.446, p = 0.2216) ni en la cantidad de neuronas (t(4)= 1.475, p= 0.2143) entre el DIV 1 y el 10. Sin embargo, el porcentaje de neuronas si mostró una diferencia significativa (t(4)= 21.61, p= <0.0001) ( VER FIGURA 2). Con respecto a los astrocitos, se determinó que al DIV 10, la cantidad era de 7,024 + 3,617 (densidad de 62 astrocitos/mm2), representando el 2.8 % de las células.
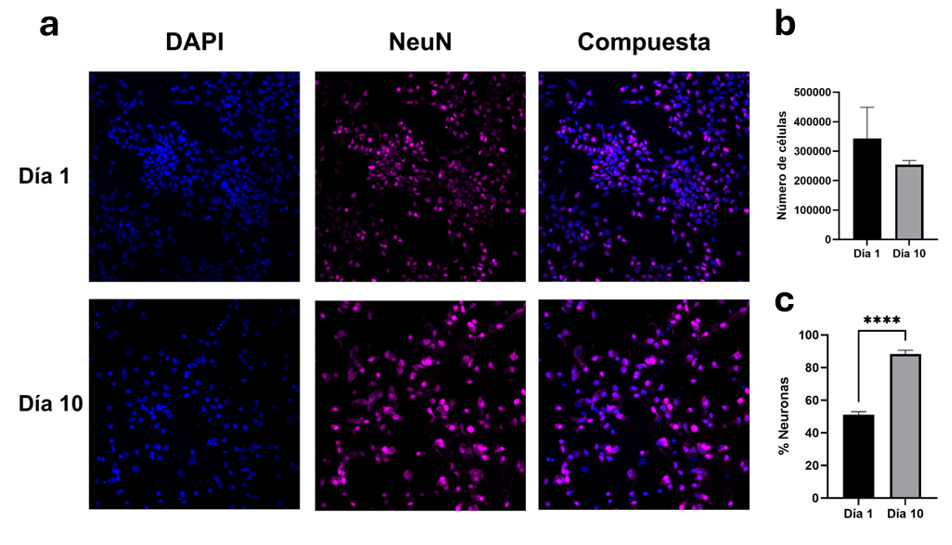
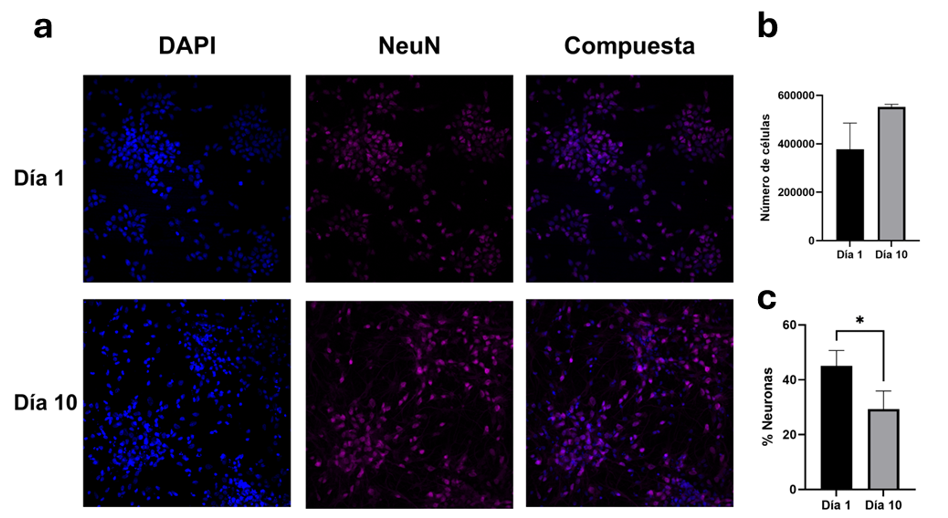
Cultivos mixtos
En las primeras veinticuatro horas (DIV 1), los cultivos mixtos mostraban un total de 377,700 + 108,211 células, lo que demuestra una supervivencia a la siembra del 75.5 %. Las neuronas contabilizaron un total de 167,850 + 40,593, representando un 45,02 + 5.62. %. Al DIV 10, los cultivos mixtos mostraban un total de 552,177 + 11,218 células, representando un incremento del 46.2 % con respecto al DIV 1. Del total de células, 164,499 + 37,061 eran neuronas, lo que representaba el 29.33 + 6.59 %. Los cultivos mixtos no mostraron una diferencia significativa en el número de células entre el DIV 1 y el DIV 10 (t(2)= 2.78, p=0.106), ni tampoco en la cantidad de neuronas (t(4)= 0.10, p=0.921). Sin embargo, se encontró una diferencia significativa en el porcentaje de neuronas entre ambos días (t(4)= 3.141, p<0.05) ( VER FIGURA 3). Al evaluar los astrocitos en el DIV 10, se cuantificaron un total de 23,532 + 5,145 (densidad 208 astrocitos/mm2), representando el 4.26 % de las células del cultivo.
Comparación de cultivos
No se encontró diferencia estadísticamente significativa entre el número de células (t(4)= 0.399, p=0.71), el número de neuronas (t(4)= 0.169, p=0.87) o el porcentaje de neuronas (t(4)= 1.759, p=0.15) entre los cultivos mixtos y enriquecidos a las 24 horas de haber sido sembradas. Comparando ambos cultivos al DIV 10 se determinó que existe una diferencia significativa entre la cantidad de células (t(4)= 28.68, p<0.0001) y el porcentaje de neuronas (t(4)= 14.68, p<0.0001), sin embargo, no hubo diferencia significativa entre el total de neuronas (t(4)= 2.645, p=0.057) ( VER FIGURA 4). Al evaluar los astrocitos se encontró diferencia significativa entre la cantidad de astrocitos (t(4)= 4.547, p<0.05) ( VER FIGURA 5).
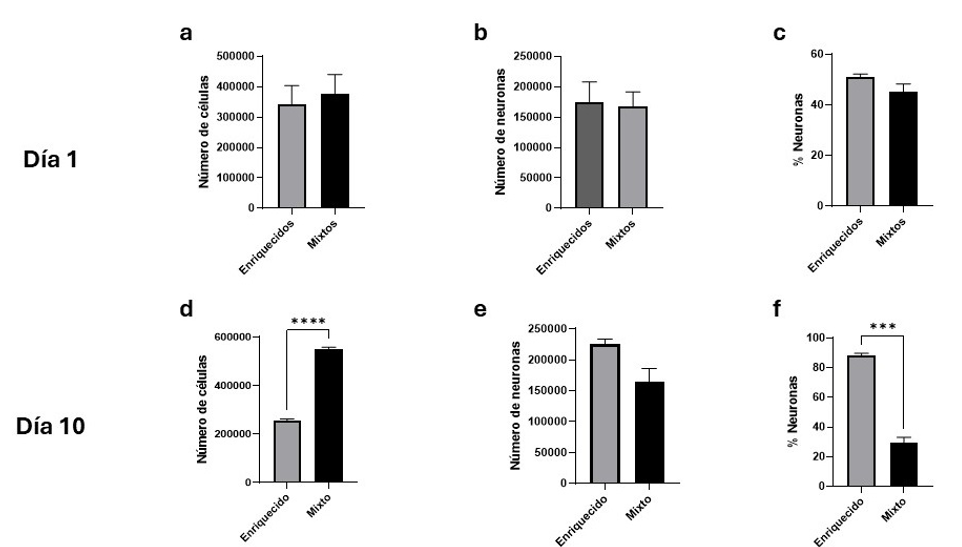
El desarrollo de los cultivos neuronales primarios es un proceso complejo que amerita habilidad y experiencia para ser realizado [10], [14]. Estos cultivos permiten estudiar el comportamiento de células cerebrales en ambientes menos complejos que los organismos vivos [15], [16]. En la medida que los modelos in vitro repliquen las características y comportamientos celulares que se presentan en los organismos vivos, serán más adecuados para su uso en experimentación y además cumplirán con el concepto de las 3R para el uso responsable de los animales en investigación científica [13].
La disociación celular de los tejidos es un proceso estresante que afecta la viabilidad celular [17], [18]; sin embargo, esta afectación no se reporta regularmente en las publicaciones. Hemos encontrado que a las 24 horas de la disociación la viabilidad del cultivo presenta una disminución del 30 %. Estos resultados son similares a lo descrito por Turovsky en cultivos corticales de ratones NMRI, en donde la disminución estuvo entre 30 y 40 % [19]. Estos datos demuestran el gran impacto que produce el proceso de siembra en la viabilidad celular y deben ser tomados en cuenta al momento de la experimentación y el análisis de los resultados.
El establecimiento de modelos enriquecidos y mixtos es necesario para entender el comportamiento de linajes celulares independientes, así como la interacción entre distintas poblaciones celulares [20], [21], [22]. En nuestros experimentos, ambos tipos de cultivo mostraron resultados similares en la cuantificación celular a las 24 horas; sin embargo, al DIV 10 mostraron diferencias significativas. Identificamos diferencias en el número total de células y en la proporción de neuronas, pero no en la cantidad total de neuronas entre los cultivos mixtos y enriquecidos. Esto se debe al efecto de la citarabina aplicada en los cultivos enriquecidos, ya que este compuesto afecta la mitosis en las células no neuronales, disminuyendo su capacidad de proliferación y viabilidad, debido a que las neuronas no realizan mitosis estos compuestos no las afectan por lo que su número total se mantiene. Existe en la literatura una discusión sobre la necesidad o no de estos compuestos para producir cultivos enriquecidos. Diversos protocolos aseguran obtener cultivos neuronales con 98% de neuronas sin la utilización de estos compuestos [14], [23], [24], mientras que otros no logran estos valores sin utilizarlos [10], [18], [22], [25], [26], [27]. Existen artículos que han observado efectos deletéreos de estos compuestos sobre las neuronas si se mantienen durante mucho tiempo en el cultivo [10], aunque hay estudios que lo contradicen [28]. En nuestra experiencia, para obtener los cultivos enriquecidos de neuronas aisladas de la corteza de embriones E17, necesitamos utilizar agentes antimitóticos. Observamos que la exposición prolongada a citarabina disminuía la viabilidad del cultivo, por lo que los cultivos se expusieron únicamente durante 48 horas para evitar efectos deletéreos.
Al DIV 10, el 50 % de las células sembradas en nuestros cultivos enriquecidos de neuronas se mantuvieron viables. Este resultado es similar al 40 % de sobrevivencia descrito por Turovsky [19]. La proporción de neuronas en nuestros cultivos estuvo alrededor del 90 %, acercándose al 99 % de los cultivos descritos por Brewer et al. y Cullen et al. [23], [24]. En nuestros cultivos mixtos observamos un aumento del 10% de todas las células con respecto a las sembradas inicialmente, mientras que la proporción de neuronas disminuyó a un 30 %, encontrándose en un punto intermedio entre la proporción de la corteza humana (21%) y de rata (40%) [29], [30]. Tomando en cuenta estos resultados, consideramos que este modelo mixto replica de manera adecuada la proporción de neuronas en modelos in vivo.
La cantidad de astrocitos en nuestros cultivos enriquecidos al DIV 10 estuvo alrededor del 3 % mientras que en nuestros cultivos mixtos rondaron el 4 %. Estos valores están dentro del rango de lo descrito por Sahu y también por Beaudoin, en donde entre el DIV 7 y 14 los astrocitos rondaban del 2 al 6 % [10], [14]. Analizando los datos podemos inferir que el mayor número de células presentes en los cultivos mixtos al DIV 10 no son neuronas ni astrocitos, sino, probablemente una combinación de otras células gliales [26], [31], Son necesarios estudios adicionales para caracterizar estas poblaciones adicionales.
Hemos establecido dos protocolos para producir cultivos neuronales primarios: un protocolo para cultivos enriquecidos de neuronas y otro para cultivos mixtos. El cultivo enriquecido podrá ser utilizados para entender el comportamiento específico de las neuronas y su respuesta a diferentes intervenciones, mientras que el cultivo mixto permitirá entender la interacción de las neuronas con las demás células cerebrales y las respuestas que esa interacción produzca. Estos modelos in vitro establecen una plataforma experimental para evaluar condiciones neurológicas y estudiar nuevos mecanismos y avenidas terapéuticas para intervención de estos trastornos.
Referencias
[1] PAHTO, “Burden of Neurological Conditions,” 2021. Accessed: Oct. 29, 2023. [Online]. Available: https://www.paho.org/en/enlace/burden-neurological-conditions
[2] J. D. Steinmetz et al., “Global, regional, and national burden of disorders affecting the nervous system, 1990–2021: a systematic analysis for the Global Burden of Disease Study 2021,” Lancet Neurol, vol. 23, no. 4, pp. 344–381, Apr. 2024, doi: 10.1016/S1474-4422(24)00038-3.
[3] Ministerio de Salud de Panamá, “Defunciones y Tasa de Mortalidad de las Principales Causas de Muerte en la República, por Sexo, Según Causa: Año 2021,” Panamá, 2021.
[4] Ministerio de Salud de Panamá, “Defunciones y Tasa de Mortalidad de las Principales Causas de Muerte en la República, por Sexo, Según Causa: Año 2002,” Panamá, 2002.
[5] Ministerio de Salud de Panamá, “Defunciones y Tasa de Mortalidad de las Principales Causas de Muerte en la República, por Sexo, Según Causa: Año 2012,” Panamá, 2012.
[6] M. D. Hurd, I. Goel, Y. Sakai, and Y. Teramura, “Current status of ischemic stroke treatment: From thrombolysis to potential regenerative medicine,” Regen Ther, vol. 18, p. 408, Dec. 2021, doi: 10.1016/J.RETH.2021.09.009.
[7] S. Kumar, “Overcoming gaps in the treatment of neurodegenerative disease,” EBioMedicine, vol. 60, p. 103088, Oct. 2020, doi: 10.1016/j.ebiom.2020.103088.
[8] T. B. Stoker and R. A. Barker, “Recent developments in the treatment of Parkinson’s Disease,” F1000Res, vol. 9, 2020, doi: 10.12688/F1000RESEARCH.25634.1.
[9] E. J. Huang and L. F. Reichardt, “Neurotrophins: Roles in Neuronal Development and Function,” Annu Rev Neurosci, vol. 24, p. 677, 2001, doi: 10.1146/ANNUREV.NEURO.24.1.677.
[10] G. M. J. Beaudoin et al., “Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex,” Nat Protoc, vol. 7, no. 9, pp. 1741–1754, 2012, doi: 10.1038/nprot.2012.099.
[11] A. Verma, M. Verma, and A. Singh, “Animal tissue culture principles and applications,” Anim Biotechnol, p. 269, Jan. 2020, doi: 10.1016/B978-0-12-811710-1.00012-4.
[12] U. Björklund, M. Persson, L. Rönnbäck, and E. Hansson, “Primary cultures from cerebral cortex and hippocampus enriched in glutamatergic and GABAergic neurons,” Neurochem Res, vol. 35, no. 11, pp. 1733–1742, Nov. 2010, doi: 10.1007/S11064-010-0236-X.
[13] B. Denis, R. De Jesus, and R. A. Gittens, “Estimating attrition of Sprague Dawley rats for research involving primary neuronal cultures.” Accessed: Nov. 06, 2024. [Online]. Available: https://revistas.unne.edu.ar/index.php/vet/article/view/7858/7380
[14] M. P. Sahu, O. Nikkiï, S. L. ˚ Agas, S. Kolehmainen, E. Castrén, and C. Castrén, “Culturing primary neurons from rat hippocampus and cortex,” Neuronal Signal, vol. 3, p. 20180207, 2019, doi: 10.1042/NS20180207.
[15] K. A. Hossmann, “Experimental models for the investigation of brain ischemia,” Cardiovasc Res, vol. 39, no. 1, pp. 106–120, 1998, doi: 10.1016/S0008-6363(98)00075-3.
[16] C. J. Sommer, “Ischemic stroke: experimental models and reality,” Acta Neuropathol, vol. 133, no. 2, p. 245, Feb. 2017, doi: 10.1007/S00401-017-1667-0.
[17] Z. Ahmed, P. S. Walker, and R. E. Fellows, “Properties of neurons from dissociated fetal rat brain in serum-free culture,” J Neurosci, vol. 3, no. 12, pp. 2448–2462, 1983, doi: 10.1523/JNEUROSCI.03-12-02448.1983.
[18] M. Ivenshitz and M. Segal, “Neuronal density determines network connectivity and spontaneous activity in cultured hippocampus,” J Neurophysiol, vol. 104, no. 2, pp. 1052–1060, Aug. 2010, doi: 10.1152/JN.00914.2009/SUPPL_FILE/LEGENDS.PDF.
[19] E. A. Turovsky, V. N. Mal’tseva, R. M. Sarimov, A. V. Simakin, S. V. Gudkov, and E. Y. Plotnikov, “Features of the cytoprotective effect of selenium nanoparticles on primary cortical neurons and astrocytes during oxygen–glucose deprivation and reoxygenation,” Sci Rep, vol. 12, no. 1, p. 1710, Dec. 2022, doi: 10.1038/S41598-022-05674-1.
[20] G. J. Brewer, J. R. Torricelli, E. K. Evege, and P. J. Price, “Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination,” J Neurosci Res, vol. 35, no. 5, pp. 567–576, 1993, doi: 10.1002/JNR.490350513.
[21] N. Goshi, R. K. Morgan, P. J. Lein, and E. Seker, “A primary neural cell culture model to study neuron, astrocyte, and microglia interactions in neuroinflammation,” J Neuroinflammation, vol. 17, no. 1, pp. 1–16, May 2020, doi: 10.1186/S12974-020-01819-Z/FIGURES/5.
[22] S. Kaech and G. Banker, “Culturing hippocampal neurons,” Nat Protoc, vol. 1, no. 5, pp. 2406–2415, Dec. 2006, doi: 10.1038/NPROT.2006.356.
[23] G. J. Brewer, “Isolation and culture of adult rat hippocampal neurons,” J Neurosci Methods, vol. 71, no. 2, pp. 143–155, Feb. 1997, doi: 10.1016/S0165-0270(96)00136-7.
[24] D. K. Cullen, M. E. Gilroy, H. R. Irons, and M. C. Laplaca, “Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures,” Brain Res, vol. 1359, p. 44, Nov. 2010, doi: 10.1016/J.BRAINRES.2010.08.058.
[25] H. M. Lesslich, L. Klapal, J. Wilke, A. Haak, and I. D. Dietzel, “Adjusting the neuron to astrocyte ratio with cytostatics in hippocampal cell cultures from postnatal rats: A comparison of cytarabino furanoside (AraC) and 5-fluoro-2’-deoxyuridine (FUdR),” PLoS One, vol. 17, no. 3, Mar. 2022, doi: 10.1371/JOURNAL.PONE.0265084.
[26] F. Löffner, S. M. Lohmann, B. Walckhoff, U. Walter, and B. Hamprecht, “Immunocytochemical characterization of neuron-rich primary cultures of embryonic rat brain cells by established neuronal and glial markers and by monospecific antisera against cyclic nucleotide-dependent protein kinases and the synaptic vesicle protein sy,” Brain Res, vol. 363, no. 2, pp. 205–221, 1986, doi: 10.1016/0006-8993(86)91006-1.
[27] D. Pozzi, J. Ban, F. Iseppon, and V. Torre, “An improved method for growing neurons: Comparison with standard protocols,” J Neurosci Methods, vol. 280, pp. 1–10, Mar. 2017, doi: 10.1016/J.JNEUMETH.2017.01.013.
[28] J. Schwieger, K. H. Esser, T. Lenarz, and V. Scheper, “Establishment of a long-term spiral ganglion neuron culture with reduced glial cell number: Effects of AraC on cell composition and neurons,” J Neurosci Methods, vol. 268, pp. 106–116, Aug. 2016, doi: 10.1016/J.JNEUMETH.2016.05.001.
[29] F. A. C. Azevedo et al., “Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain,” Journal of Comparative Neurology, vol. 513, no. 5, pp. 532–541, Apr. 2009, doi: 10.1002/cne.21974.
[30] S. Herculano-Houzel, B. Mota, and R. Lent, “Cellular scaling rules for rodent brains,” Proc Natl Acad Sci U S A, vol. 103, no. 32, pp. 12138–12143, Aug. 2006, doi: 10.1073/PNAS.0604911103/SUPPL_FILE/04911FIG5.JPG.
[31] C. S. von Bartheld, J. Bahney, and S. Herculano-Houzel, “The Search for True Numbers of Neurons and Glial Cells in the Human Brain: A Review of 150 Years of Cell Counting,” J Comp Neurol, vol. 524, no. 18, p. 3865, Dec. 2016, doi: 10.1002/CNE.24040.
enviar
suscripperonal
Información
Idioma





